Por: Laia Torregrosa Sauret (Resp. Dept. R+D)
1. Introducción
El brócoli es un producto vegetal con un creciente interés por sus grandes propiedades nutricionales, es muy rico en vitaminas, antioxidantes y compuestos anticancerígenos (Guo et al., 2013; Podsedek, 2007). Una vez cosechado su calidad sensorial sufre una rápida reducción, manifestándose, por ejemplo, con una pérdida del color verde y volviéndose de un color amarillento con apariencia indeseable (Funamoto et al., 2002). La senescencia también conlleva la alteración de los tejidos, la peroxidación lipídica, la degradación de las proteínas y la pérdida de compuestos antioxidantes, lo que disminuye el valor nutricional del producto (Page et al., 2001). Sus cualidades visuales y organolépticas dependen en gran medida de las condiciones de almacenamiento (Makhlouf et al., 1989a).

2. La respiración
El brócoli es un producto muy perecedero con una elevada tasa respiratoria (Tabla 1) y una baja producción de etileno, <0.1 μL kg-1 h-1 a 20°C y es extremadamente sensible a la exposición del etileno. Es importante tener en cuenta que durante su vida postcosecha el brócoli puede generar hasta 35 000 BTU de calor por tonelada de brócoli por día a 5°C. En comparación, el calor respiratorio del brócoli a 5°C es hasta cinco veces mayor que el calor generado por la lechuga y hasta 70 veces mayor que muchas otras verduras o frutas. El brócoli tiene una vida útil muy corta, es por ello por lo que es preciso estudiar tratamientos de conservación que permitan alargarla, manteniendo la calidad postcosecha.

3. Tratamientos para alargar la vida útil
3.1 Altas temperaturas
Una de las tecnologías más aplicadas es la de aplicar altas temperaturas durante un período corto de tiempo. Diferentes estudios han mostrado resultados muy positivos, como por ejemplo, Funamoto et al. (2002), aplicó un tratamiento de calor a 50ºC durante 2h y observó una reducción de las enzimas degradantes de la clorofila. En otro estudio realizado con un tiempo más corto se observó que el brócoli tratado con agua caliente a 45°C durante 14 min, disminuyó la tasa respiratoria, la producción de etileno y retrasó el amarillamiento aparente durante 2-3 días a 20°C de almacenamiento (Kazami et al., 1991). Tian et al. (1996) concluyeron que el brócoli tratado con agua caliente a 47°C durante 7.5 minutos retrasó la decoloración amarillenta del flósculo. Por otro lado, Terai et al. (1999) realizaron un tratamiento con aire caliente a 50ºC durante 2 y 3h y encontraron una inhibición efectiva del amarillamiento del flósculo, y el tratamiento durante 3h retrasó fuertemente la actividad enzimática, como la aminociclopropanocarboxilato oxidasa y la ACC oxidasa.
3.2 Bajas temperaturas
También se han estudiado las ventajas de la refrigeración, Toivonen (1997) determinó los efectos de la duración del almacenamiento en frío y la temperatura de almacenamiento en la vida útil del brócoli envasado y su posterior vida útil para simular las condiciones de venta al por menor. Además, evaluó el efecto del hidrocooling antes de su embalaje. Observó que la firmeza del brócoli y la retención del color se pueden mantener fácilmente durante 5 días a temperaturas de vida útil aplicando un preenfriamiento con hidrocooling, usando un embalaje microperforado y con un almacenamiento en frío a 1°C. Por otro lado Zhuang et al. (1997), investigaron el efecto de la temperatura sobre la peroxidación lipídica y el deterioro de los brotes de brócoli durante la postcosecha. Los brotes de brócoli se envasaron en bolsas de película polimérica microperforada y se almacenaron a diferentes temperaturas (2, 13 y 23 °C) durante 144 h y concluyeron que los aumentos en la temperatura aceleran el deterioro y la peroxidación lipídica de los brotes de brócoli. Burg (2004) mantuvo el brócoli durante 4 días a 1.1 °C y luego a 0 °C y 10 mm Hg o a presión atmosférica durante 21 días. Después evaluó su calidad durante la vida útil a 10 °C y concluyó que los que se habían almacenado bajo presión atmosférica tenían un 60–90% de amarillamiento y se redujo hasta el 40% en aquellos que habían estado en almacenamiento hipobárico y no desarrollaron ni olores ni sabores desagradables.
Otros estudios han aplicado distintos tipos de tratamientos. Por ejemplo, Costa et al. (2006) trataron el brócoli con distintas dosis luz ultravioleta: 4, 7, 10 y 14 kJ m−2. Todos los tratamientos retrasaron el amarillamiento aparente y la degradación de la clorofila a 20°C, pero la dosis de irradiación de 10 kJ m−2 permitió retener el contenido más alto de clorofila, en cambio mostró una menor cantidad de feofitinas que el tratamiento a 7 kJ m– 2. Ma et al. (2012), encontraron resultados muy prometedores aplicando atomización electrostática para ralentizar la senescencia del brócoli, aunque se necesitaría más investigación para poder reafirmar los efectos beneficiosos de este tratamiento.

Por otro lado, se han realizado distintos estudios con brotes de brócoli cortados haciendo uso de embalajes de atmósfera modificada (Jones et al., 2006; Serrano et al., 2006), aplicaciones de vapor de etanol (Han et al., 2006) y la aplicación del 1-metilciclopropeno (1-MCP) (Ku and Wills, 1999; Xu et al., 2016; Yuan et al., 2010).
3.3 Atmósferas controladas
Sin embargo, la amplia influencia del oxígeno y el dióxido de carbono en el metabolismo de las plantas ha llevado al uso de atmósferas modificadas para extender la duración del almacenamiento y la vida útil de frutas y verduras. La respuesta de los productos hortofrutícolas cuando se conservan bajo atmósferas modificadas varía según la especie, la variedad y el grado de madurez, y pueden tener respuestas fisiológicamente beneficiosas o no deseadas (Eason et al., 2007). Se desea conseguir un enlentecimiento de la senescencia, reduciendo la tasa respiratoria, la decoloración, el daño oxidativo, la degradación de la clorofila y la sensibilidad al etileno (Beaudry, 1999). Por otro lado, una disminución excesiva de O2 y un exceso de CO2 podrían inducir a la fermentación del producto, desarrollando sabores desagradables, una reducción de la biosíntesis de aroma y una inducción de daño tisular (Beaudry, 1999).
Es por ello por lo que hay un creciente interés en conservar brócoli bajo condiciones de atmósfera controlada (AC) e atmósfera controlada dinámica (DCA, de sus siglas en inglés). Hay numerosos estudios que investigan la adaptación del brócoli durante la conservación bajo condiciones de AC. El uso de atmósferas con 10% CO2 y 1% O2 puede prolongar la conservación del brócoli a 5 °C. Niveles mayores de CO2 o menores de O2 pueden ocasionar olor y sabor desagradables en el producto (Toledo H., 2003). En la bibliografía se muestran resultados muy favorables al uso de AC al almacenar este tipo de vegetal. Por ejemplo Praeger and Weichmann (2001), concluyeron que la tasa de respiración del brócoli ‘Emperador’ disminuyó a medida que la concentración de O2 de la atmósfera también decrecía incluso a 0% durante un período de 24 h a 10 ºC y a 20 °C. Por otro lado, Makhlouf et al. (1989b) almacenaron brócoli bajo distintas concentraciones, los resultados más positivos se encontraron al almacenar el brócoli durante 3 semanas bajo una concentración de 6 kPa CO2+2.5 kPa O2, ya que no mostró daños fisiológicos y retrasó la aparición de podredumbre blanda y moho. Yang and Henze (1988) también encontraron una reducción en la senescencia del vegetal cuando almacenaron brócoli bajo una atmósfera de 5-10 kPa CO2+3 kPa O2. Cuando el brócoli fue almacenado a 10 kPa CO2+11 kPa O2 a 4ºC se extendió su período de vida útil y redujo significativamente el crecimiento de microorganismos (Berrang et al., 1990). Las condiciones de AC recomendadas para brócoli se encuentran entre el 1 y el 2% O2 y entre el 5 al 10% de CO2 a temperaturas entre 0 y 5ºC (Cantwell and Suslow, 2002; Makhlouf et al., 1989a). Almacenar brócoli bajo condiciones óptimas de AC puede llegar a doblar su periodo de conservación (Toivonen and Forney, 2016).
3.3.1 Atmósfera dinámica controlada
La tecnología de DCA requiere un control preciso de las concentraciones de gases y el monitoreo de la respuesta metabólica del producto, para asegurar que el proceso de fermentación (respiración anaeróbica) no se inicia. La DCA permite la personalización de los niveles de O2 en el interior de la cámara en función del estado fisiológico de los productos hortofrutícolas durante el período de almacenamiento para maximizar la retención de la calidad de la fruta. Consiste en reducir el nivel de oxígeno de la atmósfera al mínimo tolerado por la fruta, también llamado nivel de oxígeno más bajo (LOL, de sus siglas en inglés) y mantenerlo lo más cerca posible del punto de compensación anaeróbico (ACP), pero siempre por encima del umbral de fermentación (Img. 1). En tales condiciones, los procesos de oxidación y senescencia se ralentizan.
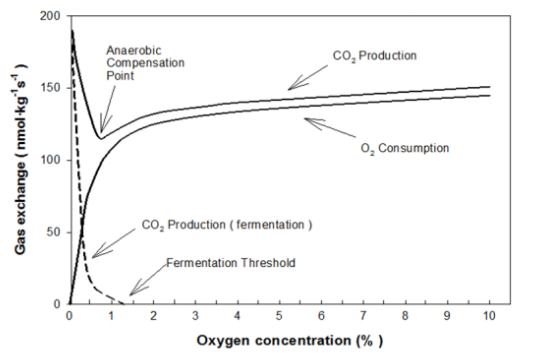
Al trabajar en condiciones tan cerca del límite de fermentación, la respuesta metabólica de los productos hortofrutícolas tiene que ser monitoreada por un sensor y las concentraciones de gas del interior de la cámara en DCA se regulan de acuerdo con la señal proporcionada por este sensor. Actualmente, en el mercado hay tres tipos de sensores basados en mediciones de: fluorescencia de clorofila (DCA-CF), cociente respiratorio (DCA-RQ) y contenido de etanol en la pulpa de la fruta (DCA-EtOH) y en la atmósfera de cámara (DCA-DCS). Prange et al. (2005) utilizaron el concepto de DCA para monitorear la conservación del brócoli mediante un sensor de fluorescencia. Determinaron el umbral de fermentación y la fluorescencia de la clorofila del brócoli conservado a niveles bajos de O2 a 20ºC dentro de recipientes de 4 L con un flujo constante de gases, expuestos a una disminución de la concentración de O2 (anoxia) y con un retorno posterior a la normoxia (aire). La fluorescencia del brócoli mostró un pico a 0.34 kPa de O2 al mismo tiempo que el vegetal produjo un pico de etanol.
Estas tecnologías están ampliamente investigadas para largas conservaciones de fruta, aunque en base a los resultados publicados, las tecnologías disponibles en el mercado no parecen ser completamente efectivas. Pero no se han realizado prácticamente estudios para almacenar vegetales bajo condiciones de DCA.
4. Referencias
Beaudry, R.M., 1999. Effect of O2 and CO2 partial pressure on selected phenomena affecting fruit and vegetable quality. Postharvest Biol. Technol. 15, 293–303. https://doi.org/10.1016/S0921-4534(03)01088-8
Berrang, M.E., Brackett, R.E., Beuchat, L.R., 1990. Microbial, color and textural qualities of Fresh Asparagus, Broccoli, and cauliflower stored under controlled atmosphere. J. Food Prot. 53, 391–395. https://doi.org/10.4315/0362-028X-53.5.391
Burg, S.P., 2004. Postharvest physiology and hypobaric storage of fresh produce. CAB International.
Cantwell, M., Suslow, T., 2002. Broccoli: recommendations for maintaining postharvest quality [WWW Document]. (Accesed 28 maig,2020).
Costa, L., Vicente, A.R., Civello, P.M., Chaves, A.R., Martínez, G.A., 2006. UV-C treatment delays postharvest senescence in broccoli florets. Postharvest Biol. Technol. 39, 204–210. https://doi.org/10.1016/j.postharvbio.2005.10.012
Eason, J.R., Ryan, D., Page, B., Watson, L., Coupe, S.A., 2007. Harvested broccoli (Brassica oleracea) responds to high carbon dioxide and low oxygen atmosphere by inducing stress-response genes. Postharvest Biol. Technol. 43, 358–365. https://doi.org/10.1016/j.postharvbio.2006.10.001
Funamoto, Y., Yamauchi, N., Shigenaga, T., Shigyo, M., 2002. Effects of heat treatment on chlorophyll degrading enzymes in stored broccoli (Brassica oleracea L.). Postharvest Biol. Technol. 24, 163–170. https://doi.org/10.1016/S0925-5214(01)00135-1
Guo, Y., Gao, Z., Li, L., Wang, Y., Zhao, H., Hu, M., Li, M., Zhang, Z., 2013. Effect of controlled atmospheres with varying O2/CO2 levels on the postharvest senescence and quality of broccoli (Brassica oleracea L. var. italica) florets. Eur. Food Res. Technol. 237, 943–950. https://doi.org/10.1007/s00217-013-2064-0
Han, J., Tao, W., Hao, H., Zhang, B., Jiang, W., Niu, T., Li, Q., Cai, T., 2006. Physiology and quality responses of fresh-cut broccoli florets pretreated with ethanol vapor. J. Food Sci. 71, 6–10. https://doi.org/10.1111/j.1750-3841.2006.00042.x
Jones, R.B., Faragher, J.D., Winkler, S., 2006. A review of the influence of postharvest treatments on quality and glucosinolate content in broccoli (Brassica oleracea var. italica) heads. Postharvest Biol. Technol. 41, 1–8. https://doi.org/10.1016/j.postharvbio.2006.03.003
Kazami, D., Sato, T., Nakagawa, H., Ogura, N., 1991. Effect of pre-storage hot water dipping of broccoli heads on shelf life and quality during storage. Nippon Nogeikagaku Kaishi 65, 19–26. https://doi.org/10.1271/nogeikagaku1924.65.19
Ku, V.V.V., Wills, R.B.H., 1999. Effect of 1-methylcyclopropene on the storage life of broccoliEffect of 1-methylcyclopropene on the storage life of broccoli. Postharvest Biol. Technol. 17, 127–132. https://doi.org/10.1016/S0925-5214(99)00042-3
Ma, G., Zhang, L., Kato, M., Yamawaki, K., Asai, T., Nishikawa, F., Ikoma, Y., Matsumoto, H., Yamauchi, T., Kamisako, T., 2012. Effect of electrostatic atomization on ascorbate metabolism in postharvest broccoli. Postharvest Biol. Technol. 74, 19–25. https://doi.org/10.1016/j.postharvbio.2012.07.001
Makhlouf, J.M., Castaigne, F., Arul, J., Willemot, C., Gosselin, A., 1989a. Long-term storage of broccoli under controlled atmosphere. J. Am. Soc. Hortic. Sci. 114, 955–958.
Makhlouf, J.M., Willemot, C., Arul, J., Castaigne, F., Emond, J.P., 1989b. Regulation of ethylene biosynthesis in broccoli flower buds in controlled atmospheres. J. Am. Soc. Hortic. Sci. 114, 955–958.
Page, T., Griffiths, G., Buchanan-Wollaston, V., 2001. Molecular and biochemical characterization of postharvest senescence in broccoli. Plant Physiol. 125, 718–727. https://doi.org/10.1104/pp.125.2.718
Podsedek, A., 2007. Natural antioxidants and antioxidant capacity of Brassica vegetables: A review. LWT – Food Sci. Technol. 40, 1–11. https://doi.org/10.1016/j.lwt.2005.07.023
Praeger, U., Weichmann, J., 2001. Influence of oxygen concentration on respiration and oxygen partial pressure in tissue of broccoli and cucumber. Acta Hortic. 553, 679–681.
Prange, R.K., Delong, J.M., Harrison, P.A., 2005. Quality management through respiration control: Is there a relationship between lowest acceptable respiration, chlorophyll fluorescence and cytoplasmic acidosis? Acta Hortic. 682, 823–830. https://doi.org/10.17660/ActaHortic.2005.682.107
Prange, R.K., Delong, J.M., Wright, A.H., 2011. Storage of pears using dynamic controlled-atmosphere (DCA), a non-chemical method, in: Acta Horticulturae. pp. 707–718.
Serrano, M., Martinez-Romero, D., Guillén, F., Castillo, S., Valero, D., 2006. Maintenance of broccoli quality and functional properties during cold storage as affected by modified atmosphere packaging. Postharvest Biol. Technol. 39, 61–68. https://doi.org/10.1016/j.postharvbio.2005.08.004
Terai, H., Kanou, M., Mizuno, M., Tsuchida, H., 1999. Inhibition of yellowing and ethylene production in broccoli florets following high temperature treatment with hot air. Food Preserv. Sci. 25, 221–227. https://doi.org/10.5891/jafps.25.221
Tian, M.S., Woolf, A.B., Bowen, J.H., Ferguson, I.B., 1996. Changes in color and chlorophyll fluorescence of broccoli florets following hot water treatment. J. Am. Soc. Hortic. Sci. 121, 310–313. https://doi.org/10.21273/jashs.121.2.310
Toivonen, P.M.A., 1997. The effects of storage temperature, storage duration, hydro-cooling, and micro-perforated wrap on shelf life of broccoli (Brassica oleracea L., Italica Group). Postharvest Biol. Technol. 10, 59–65. https://doi.org/10.1016/S0925-5214(97)87275-4
Toivonen, P.M.A., Forney, C.F., 2016. Broccoli, in: The Commercial Storage of Fruits, Vegetables, and Florist and Nursery Stocks. Agricultural Research Service, United States Department of Agriculture, pp. 248–261. https://doi.org/10.1007/978-1-4613-1127-0
Toledo H., J., 2003. Cultivo del brócoli. Inst. Nac. Investig. Agrar. 59.
Xu, F., Wang, H., Tang, Y., Dong, S., Qiao, X., Chen, X., Zheng, Y., 2016. Effect of 1-methylcyclopropene on senescence and sugar metabolism in harvested broccoli florets. Postharvest Biol. Technol. 116, 45–49. https://doi.org/10.1016/j.postharvbio.2016.01.004
Yang, Y.J., Henze, J., 1988. Influence of controlled atmosphere storage on external and internal quality features of broccoli Brassica oleracea var. italica. II. Changes in chlorophyll and carotenoid contents. Gartenbauwissenschaft 53, 41–43.
Yuan, G., Sun, B., Yuan, J., Wang, Q., 2010. Effect of 1-methylcyclopropene on shelf life, visual quality, antioxidant enzymes and health-promoting compounds in broccoli florets. Food Chem. 118, 774–781. https://doi.org/10.1016/j.foodchem.2009.05.062
Zhuang, H., Hildebrand, D.F., Barth, M.M., 1997. Temperature influenced lipid peroxidation and deterioration in broccoli buds during postharvest storage. Postharvest Biol. Technol. 10, 49–58. https://doi.org/10.1016/S0925-5214(96)00054-3



